De natuur is vaak de inspiratiebron van chemici. Zo ook van Gerard Roelfes, hoogleraar biomoleculaire chemie aan de Rijksuniversiteit Groningen. Maar wel in combinatie met traditionele chemie: Wij willen kunstmatige katalysatoren maken met de activiteit en stereoselectiviteit van enzymen, maar met een groter chemisch repertoire door het inbouwen van een overgangsmetaalkatalysator.
Omgeving
Het grote verschil tussen overgangsmetaalkatalysatoren en kunstmatige metaalenzymen zijn de interacties van de uitgangsstoffen en reactieproducten met de aminozuren van het enzym, zoals hydrofobe interacties of via waterstofbruggen. Met deze zogeheten tweede coördinatieomgeving stuurt het enzym de reactie. Hoe meer interacties, hoe sneller en selectiever de reactie verloopt. Roelfes en zijn collega's toonden al eerder aan dat DNA een prima omgeving is voor allerlei reacties. De onderzoekers koppelden een koperkatalysator aan DNA. Hiermee verlopen bijvoorbeeld Diels-Alder cycloaddities enantioselectief.
De plaats waar koper aan de DNA-helix bindt blijkt cruciaal voor de activiteit van de katalysator. Het probleem is dat je bij de vorming van het DNA-kopercomplex niet kunt sturen waar koper coördineert. Gebruik je een eiwit als reactieomgeving voor het metaal, dan kun je die plaats juist heel precies kiezen, zegt Roelfes. Bovendien is het voor ons doel, de toepassing in levende cellen, het handigst om de coördinatieomgeving op basis van eiwitten te kiezen. Een cel accepteert meestal geen vreemd DNA.
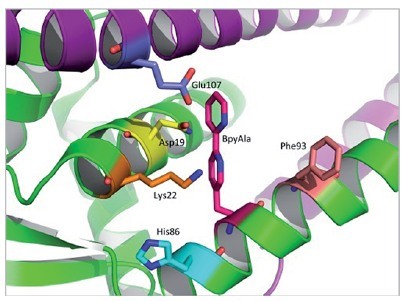
Eind vorig jaar slaagden de onderzoekers erin om een E. coli-bacterie een enzym te laten maken dat koper bindt aan het speciaal ingebouwde, niet-natuurlijke aminozuur BpyAla (zie C2W20 2014). De onderzoekers isoleerden dit kunstmatige koperenzym en lieten zien dat het een Friedel-Craftsreactie enantioselectief uitvoert. De techniek is niet beperkt tot BpyAla. Er zijn volop mogelijkheden om andere niet-natuurlijke aminozuren in te bouwen en daarme het ligand voor de katalysator te veranderen, zegt Roelfes.
Met inmiddels een Vici-subsidie op zak, wil de hoogleraar nu een enkele chemische transformatie in een levende cel uitvoeren, in plaats van het enzym eerst isoleren. Als dat werkt, dan wil ik zo'n stap inbouwen als onderdeel van een meerstaps-biosynthese. Ik wil het principe hiervan bewijzen binnen vijf jaar. Alles wordt dan in één pot door een bacterie geproduceerd. Je hoeft tussendoor geen isolatie- en zuiveringsstappen meer te doen.
Grote stap
Maar de stap naar de cel is groot. Het transport van het substraat in de cel en het product de cel uit, spelen bijvoorbeeld een rol. Bovendien mogen de katalysator en chemicaliën de cel niet beschadigen. Roelfes: Carbeenchemie zou geschikt kunnen zijn om in een cel uit te voeren. Daarmee kun je cyclopropanen maken, of CH- of XH-inserties uitvoeren. We hebben ervaring met deze reacties in het DNA-systeem. Bovendien zijn de substraten en producten bio-compatibel.
Roelfes vindt vooral het aantonen van het principe interessant. Maar hij houdt ook de toepassing in het oog. Er is veel chemie die via de conventionele weg echt niet toegankelijk is. Simpele metaalcomplexen bieden te weinig mogelijkheden tot interactie, zegt hij. Antibiotica zijn bijvoorbeeld interessante producten die je met deze systemen zou kunnen maken. Daarvan wil je graag variaties maken op natuurlijke verbindingen, maar dat is chemisch lastig. Als je met onze methode een niet-natuurlijke stap kunt inbouwen in de biosynthese van een antibioticum, kun je met wat fantasie makkelijk toegang krijgen tot nieuwe derivaten.
Dit artikel is gepubliceerd in C2W3 - 20 februari 2015.